上海研生实业有限公司品牌商
9 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
胰酶消化时间对细胞的影响?
154 人阅读发布时间:2025-11-17 15:39
胰酶消化时间是细胞培养实验中至关重要的技术参数,其精确控制直接影响细胞的活性和后续实验的可靠性。如同精准的钟表需要分秒不差的齿轮配合,细胞解离过程也需要在时间维度上实现微妙的平衡。过短的消化时间(如<3分钟)会导致细胞团块解离不完全,犹如胶着的麦芽糖难以分离,不仅降低细胞得率,更会影响后续单细胞悬液的均一性;而过长的消化时间(如>10分钟)则如同过度烹煮的食材,会显著损伤细胞膜完整性,导致胞内物质泄漏,细胞贴壁能力急剧下降。
胰酶消化时间确实是细胞培养中特别关键的一步,时间没掌握好很容易影响后续细胞状态呢。胰酶消化时间过长会直接损伤细胞,过短则导致细胞解离不完全,所以精准把控时间对维持细胞活性和功能至关重要。
⏳ 不同消化时长对细胞的影响机制
消化不足(<推荐时间50%)
细胞间连接未充分断裂,表现为细胞成团脱落(如贴壁细胞呈大片状而非单个分散),传代后易出现局部堆积,导致营养竞争不均和代谢废物积累,长期可引发空泡化或分化异常。
✅ 典型案例:HEK293细胞消化不足时,成团生长会导致部分细胞因缺氧而出现核周空泡。
适度消化(推荐时间±10%)
细胞呈单个或小团(2-5个细胞)分散,细胞膜表面蛋白(如整合素)短暂失活后可快速修复,24小时内即可重新贴壁并恢复正常增殖,细胞活力通常>95%。
⚠️ 黄金标准:倒置显微镜下观察到细胞边缘回缩、间隙增大,轻拍培养瓶壁可自然脱落。
过度消化(>推荐时间100%)
胰酶持续分解细胞膜蛋白(如钙粘蛋白),导致膜结构不可逆损伤,表现为:
贴壁能力下降(24小时贴壁率<60%)
细胞肿胀或出现凋亡小体( Annexin V染色阳性率升高)
胞内ATP水平骤降(能量代谢紊乱),间接诱发空泡化
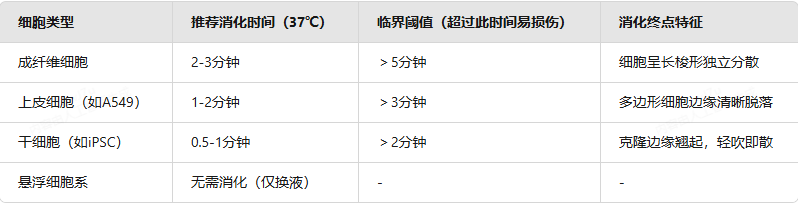
📊 常见细胞类型的消化时间参考
🛠️ 优化消化流程的实操技巧
预处理增强效率
消化前用PBS洗涤2次(去除血清残留的胰酶抑制剂),对于难消化细胞(如CHO),可提前加入0.5mM EDTA(螯合Ca²⁺促进细胞解离),但需缩短后续胰酶作用时间30%。
终止时机精准判断
采用**“镜检+时间双控法”:每30秒观察一次,当70%细胞脱落时立即加入等体积含血清培养基**(血清中的α₂-巨球蛋白可快速中和胰酶),避免震荡终止(易导致机械损伤)。
消化后修复措施
离心收集细胞时采用低转速(800rpm,5分钟),重悬时用预温培养基(37℃),并添加1% BSA(牛血清白蛋白)保护细胞膜,尤其适用于干细胞等敏感细胞。
🚫 消化相关误区与避坑指南
“宁可消化久一点,确保细胞全脱落”
❌ 错误:过度消化导致的隐性损伤(如膜蛋白丢失)可能在传代2-3代后才显现,表现为细胞形态改变或功能下降。
✅ 正确:保留少量贴壁细胞(约10%),反而可通过“饲养层效应”促进新接种细胞贴壁。
“胰酶浓度越高,消化越快”
❌ 错误:高浓度胰酶(如0.5%)会破坏细胞外基质,导致细胞失去极性。
✅ 正确:常规使用0.25%胰酶-EDTA混合液,难消化细胞可短暂提高浓度至0.5%,但严格控制时间<1分钟。
“室温消化更安全,避免37℃过度作用”
❌ 错误:室温下胰酶活性仅为37℃的1/3,延长消化时间反而增加细胞在无营养环境中的应激。
✅ 正确:37℃恒温消化,配合定时镜检,效率与安全性更优。
核心原则:消化时间不是固定值,需根据细胞代次(高代次细胞更脆弱)、培养密度(汇合度90%以上消化稍快)和胰酶批次(每批进行效价预实验)灵活调整,始终以“细胞活性优先”为标准。